싱글셀 RNA-Seq 분석을 하면서 가장 시간이 오래 걸리고 어려운 단계가 클러스터링 후에 이 클러스터가 어떤 세포의 종류인지를 구분하는 것이라고 생각합니다.
여러가지 방법이 있고, 여러가지 프로그램들이 있는데 거기에 대하여 포스팅도 쓴 적이 있습니다.
https://ruins880.tistory.com/106
싱글셀 시퀀싱 클러스터 Annotation 방법과 팁
싱글셀 시퀀싱, scRNA-Seq 분석을 하다보면 가장 험난하고 어려운 단계가 각각 클러스터의 세포 종류를 지정하는 cell type annotation 인 것 같습니다. 저도 분석을 하면서 여러가지 방법을 시도해 봤는
ruins880.tistory.com
저 방법들을 다 쓰고 데이터베이스를 뒤지고, 그리고 또 최신 논문들을 찾아보아도 어려운 건 어려운 거에요 ㅠㅠ
아니 진짜 뭔가 확실하게 딱 이거다! 라는 것도 힘들고, 소프트웨어마다 차이도 있고 하니 어렵더라구요.
그래서, 요새 학계에서 유행하는 AI에게 물어보았습니다.
일단 제일 유명한 chatGPT는 제외하고 제가 논문 쓸 때에 주로 쓰는 3가지를 써봤습니다.
chatGPT를 제외한 이유는 버전4로 바뀌면서 달라졌다고는 하지만, 없는 사실을 있는 듯하게 대답하는 경우가 많았기 때문입니다.
그래서 처음으로는 perplexity AI를 써봤습니다. UC Berkeley 출신의 팀이 만든 엔진으로, 논문 쓸 때에 특히 좋은데, 그 이유는 여러 학술 데이터베이스에서 레퍼런스를 가져옵니다.

처음에는 싱글셀 시퀀싱이 필요하다고 말하네요. 그래서 이거 싱글셀 시퀀싱 결과야 라고 말해줬습니다.

그래서 또 다른 셀 클러스터 마커들을 가져와봤습니다.
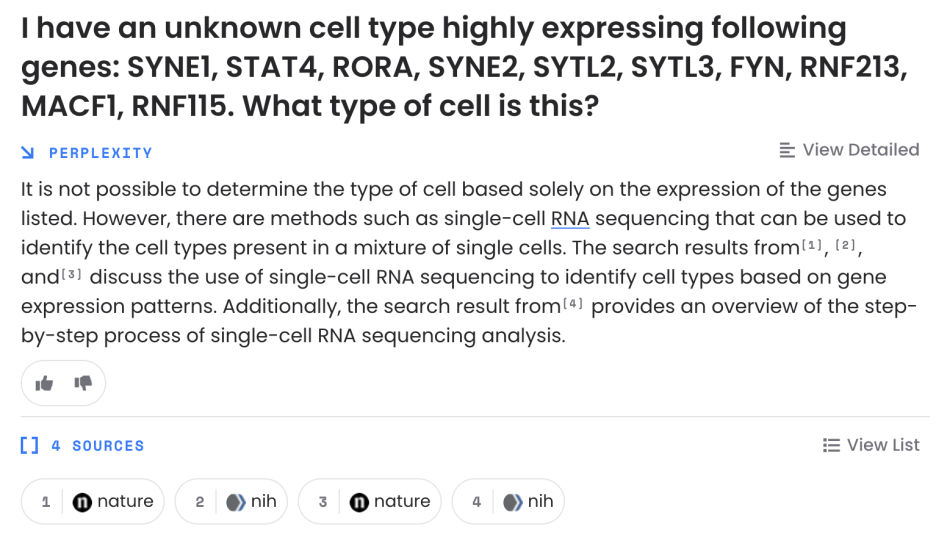
또 모른다고 하네요....
마지막으로 테스트 한 클러스터는:

NK 세포라고 말해주긴 합니다만. 아... 그건 이미 알고 있었어... 사실 NK세포의 어느 타입인지 알고 싶었던 거야.
Perplexity는 안쓰는 걸로..
다음은 Bing Chat 입니다. 마이크로소프트에서 만든 대화형 AI이며 검색에 도움을 주고 곧 마이크로소프트 오피스에도 포함될 예정이라고 하더군요. 평소에 검색할 때에 레퍼런스와 함께 결과를 가져오는 건 좋지만, 레퍼런스가 학술지가 아니라 블로그나 일반 뉴스사이트일 때가 많아서 그닥 좋아하진 않습니다. 하지만 검색을 할 때마다 마소 포인트를 주죠 ㅎ
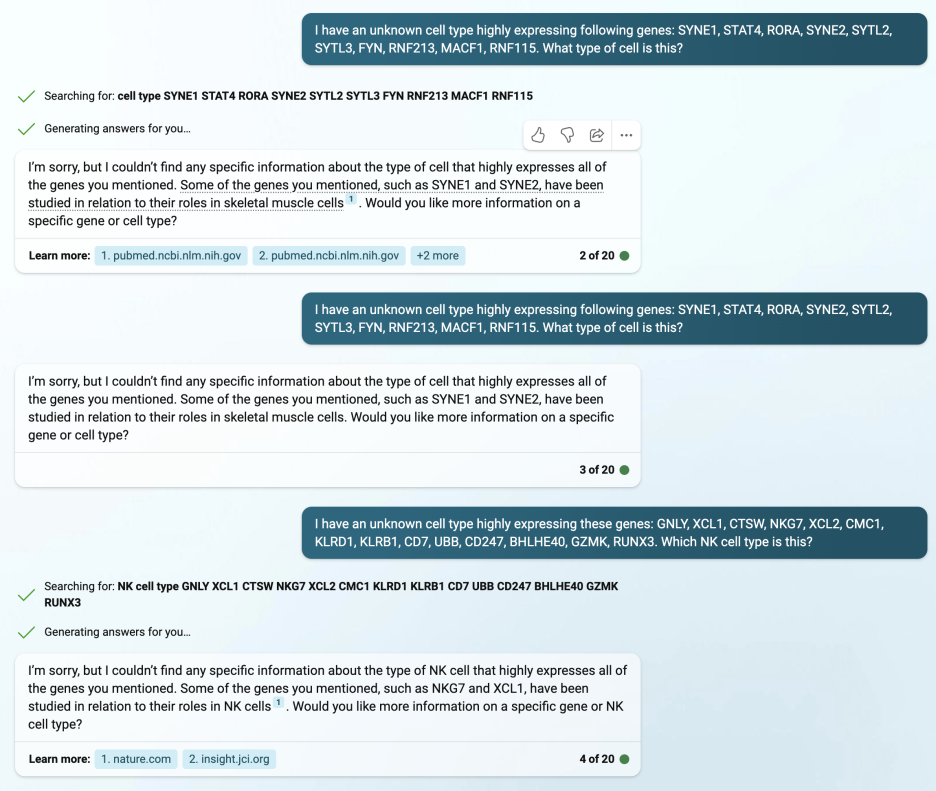
Bing Chat도 패스하는 걸로...
마지막으로 구글에서 만든 Bard 입니다. 신청자에 한해서 베타 테스트를 하게 해주는데 운좋게도 베타 테스터에 걸려서 요새 유용하게 쓰고 있습니다. 하지만, Bing Chat이나 Perplexity처럼 레퍼런스를 주진 않아요.
먼저 첫번째 데이터에 관해 물어봤습니다.

오오 쓸만하죠? B세포인 줄은 알고 있었는데 그 중 어떤거냐고 물어보니 플라즈마 세포라고 합니다. 그리고 각각의 유전자에 대해 왜 그런건지도 자세하게 설명을 해줍니다.
다음은 어떤 세포 종류인지도 모르는 데이터를 던져 주었습니다.

오 NK 세포래요. 사실 NK 세포인 줄은 알고 있었거든요. 그 중에 어떤 타입인지 궁금했었습니다. 그래서 다시 물어봤습니다.
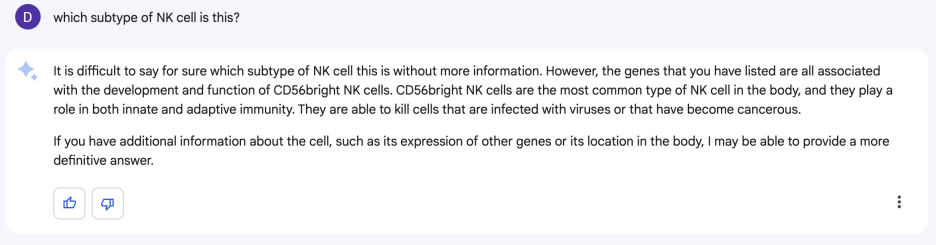
NK세포 중에 CD56bright이래요. 음... 그럴듯한데? 근데 어떤 조직에서 나온건 줄 알면 더 정확하다고 말해서 어떤 세포인지 말해줬습니다.
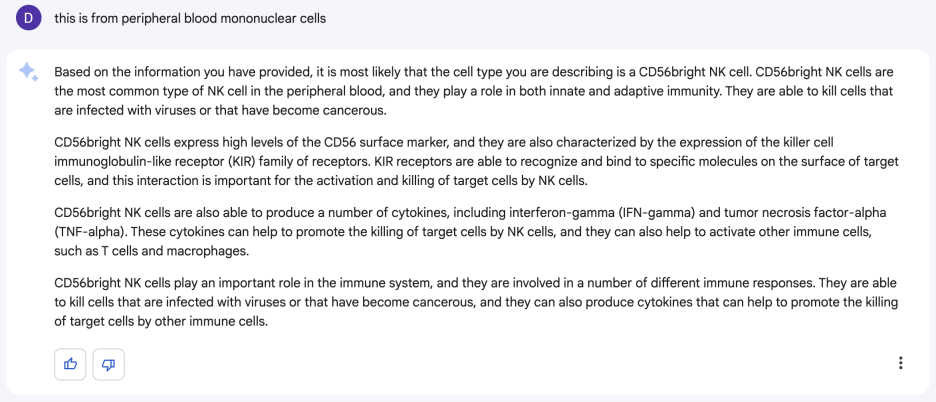
그래서 말해줬더니 아까 자기가 말한 게 맞대요. 근데 사실 조금 곤란한게, 제가 다른 클러스터를 annotation 하면서 이거 말고 다른 클러스터가 아 이건 확실하게 NK CD56bright이다 라고 생각해 놓은 게 있었거든요. 그래서 다시 물어봤죠.

뭐 그럴 수도 있대요. 아 이거 헷갈리는데.. 하고 NK CD56bright라고 점찍어 놓은 클러스터의 마커들을 올려서 물어봤습니다.

그러니까 그건 MAIT 세포래요. 제가 틀렸고 자기가 맞다니까 뭐 어쩔 수 없죠. 암튼 다른 AI에 비해서 여러모로 자세히 알려주고 결론도 도출해줘서 일단은 구글 바드 최고!!
결론: 갓구글 찬양합니다.
아, 마커들은 Seurat에서 클러스터별로 FindMakers 기능을 이용해서 찾아서 발현량 순으로 정렬하여 7-10개 정도 넣어봤습니다.
뭐 AI들이 백퍼센트 맞다고 할 순 없겠지만, 앞으로 한가지 더 테스트해볼 수 있는 방법으로 유용하게 쓰일 것 같습니다.
'Biological Science > 리서치 프로젝트' 카테고리의 다른 글
| Adrenoleukodystrophy 부신백질이영양증 (0) | 2022.05.09 |
|---|---|
| Baculovirus Expression Vector (0) | 2013.10.29 |
| Baculovirus 에 대하여 (0) | 2013.10.26 |